Difference between revisions of "SDxプロトコール"
(→溶液の調整) |
(→測定結果) |
||
| (16 intermediate revisions by the same user not shown) | |||
| Line 1: | Line 1: | ||
| − | このプロトコールは [http://en.wikipedia.org/wiki/Ionophore イオノフォア] や低分子 | + | このプロトコールは [http://en.wikipedia.org/wiki/Ionophore イオノフォア] や低分子 (2000 Da 以下の) イオンチャネルなどをテザードメンブレンに取り込み、[http://www.edaq.com/product_details_page.php?product_no=SDx-R1 tethaPod™] システムを使って膜の電導度を測定する為の手順を示したものです。測定の教材に適したイオノフォアは[http://wiki.edaq.com/index.php/Ionophores_in_Society Ionophores in Society] のアプリケーションノートに記載されています。 |
| − | + | 測定前の準備として [http://wiki.edaq.com/index.php/Tethered_Membranes テザードメンブレン] のコンセプトと [http://www.edaq.com/SDx-APP1 tethaPod ソフトウェア] の使い方を習得しておいてください。 | |
| − | このプロトコールで使用するバッファー溶液は PBS ([http://en.wikipedia.org/wiki/Phosphate_buffered_saline リン酸緩衝食塩水]) | + | このプロトコールで使用するバッファー溶液は PBS ([http://en.wikipedia.org/wiki/Phosphate_buffered_saline リン酸緩衝食塩水]) 溶液です。ただ、同様なプロトコールでも別の緩衝溶液、たとえば 0.1 M KCl、リンガー液 [https://en.wikipedia.org/wiki/Saline_(medicine) 通常の生理食塩水]、その他 [http://en.wikipedia.org/wiki/Good%27s_buffers Good 緩衝液]、 [http://en.wikipedia.org/wiki/Tris- TBS ] などを用いています。 ここに挙げる多くのイオノフォアは脂肪族カルボン酸基を持ち、pK<sub>a</sub> は約 4.5 ~ 5 を示します。これらは pH 6.5 以上では完全にイオン化し、水に優れた可溶性を示すのでpH 緩衝液として使用されています。二価の陽イオン (Mg<sup>2+</sup>、Ca<sup>2+</sup> など) に対して特異性を示すイオノフォアを扱う際は、これらのイオンを一定濃度含む緩衝溶液が必要です。 |
=== '''膜の作成''' === | === '''膜の作成''' === | ||
| Line 9: | Line 9: | ||
[http://wiki.edaq.com/index.php/How_to_assemble_a_tethaPlate_cartridge 説明書] に従って[http://www.edaq.com/main.php?url=SDx-T10 tethaPlate] をアッセンブルします。 | [http://wiki.edaq.com/index.php/How_to_assemble_a_tethaPlate_cartridge 説明書] に従って[http://www.edaq.com/main.php?url=SDx-T10 tethaPlate] をアッセンブルします。 | ||
[http://wiki.edaq.com/index.php/Making_a_tethered_membrane メンブレンの作成:] | [http://wiki.edaq.com/index.php/Making_a_tethered_membrane メンブレンの作成:] | ||
| − | # [http://www.edaq.com/SDx-S1 SDx- | + | # [http://www.edaq.com/SDx-S1 SDx-S1 リン脂質混合液,] 10 µL を各インプットウェルに注入し、2分間インキュベートして脂質二重膜を形成させる。 |
# 各ウェルに 200 µL の PBS を加える。 | # 各ウェルに 200 µL の PBS を加える。 | ||
# 続いて 200 µL の PBS で3回ウェルを洗う。 | # 続いて 200 µL の PBS で3回ウェルを洗う。 | ||
# ウエストウェルから余分の PBS を取り除く。 | # ウエストウェルから余分の PBS を取り除く。 | ||
| − | イオンチャネルの形成にエルゴステロールやコレステロールが必要な場合 (例えば Amphotericin B や Nystatin の研究など) | + | イオンチャネルの形成にエルゴステロールやコレステロールが必要な場合 (例えば Amphotericin B や Nystatin の研究など) は、膜を形成させる際に SDx-S1 リン脂質混合液に、これらの基質を加えておく必要があります。 |
==='''溶液の調整'''=== | ==='''溶液の調整'''=== | ||
| − | + | イオノフォアは通常、バイアル瓶などでミリグラムオオーダで供給されています。ストック液は供給元の容器の内容物を大きな容器に洗い出し、既知濃度に調整して保存します。通常、供給元は容器に記載したイオノフォアの量よりも多く (1 ~ 10% 程度) の量を提供します。正確に定量する必要がある場合は、使用前後の元の容器を秤量して算出します。 | |
| − | メタノール中に 1 mM | + | メタノール中に 1 mM のイオノフォアを溶かしてストック溶液とします。ストック溶液は −20°C (冷凍庫) で保存すれば長期間使用できます。一昼夜、または数日なら 2 ~ 4°C (冷蔵庫)でも保存が効きます。使用する前にストック溶液を室温に戻します。 |
| − | ここで一定量のストック溶液を PBS 緩衝液で 1:100 | + | ここで一定量のストック溶液を PBS 緩衝液で 1:100 に希釈し、10 µM (10000 nM) の希釈溶液を作成します。多くの 'lipophillic' (親油性)イオノフォアでも 10 µM 程度の濃度の水溶液なら問題なく溶かして調整できますし、それ以上濃い過飽和の状態でも構いません。 同様に、PBS緩衝液を使って 1、10、100、1000 nM の希釈溶液を作成します。 |
| − | + | 10 µM の溶液にはメタノールは僅か 1% しか含まれていません。即ち、これは水溶液と変わらない事を意味します。メタノールの濃度が高いと膜を壊したり、イオノフォアの親油性膜への配位を不完全なものにする恐れがあります。高濃度のイオノフォア溶液を使う必要がある場合は、より高濃度のストック溶液を使って (例えば 10 、ないし 100 mM、しかしこの濃度ではイオノフォアは溶けない恐れがあるので注意を要する) 、所定の濃度に希釈します。 | |
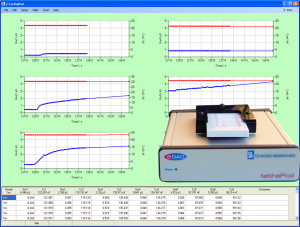
| − | [[File:tethaPod1.png|300px|thumb|right|''' | + | [[File:tethaPod1.png|300px|thumb|right|'''図 2.''' tethaPod ユニット、背景はソフトウェア]] |
=== '''イオノフォアを添加''' === | === '''イオノフォアを添加''' === | ||
| − | + | 測定を始める前に、使用する溶液が全て室温と平衡状態にあることを確認します。 | |
| − | + | tethaPod ユニットに取り付けて測定を始めます。各サンプルウェルのベースラインが安定するまで数分かかります。次の手順に従い: | |
| − | # | + | #tethaPlate のウエストウェルから 200 µL の PB 緩衝液を吸引します。 |
| − | # | + | #直ぐに、最も低濃度のイオノフォア希釈液 200 µL と入れ替えます。 |
| − | # | + | #少なくとも5分間、シグナルが安定するまで膜の電導度を記録します。 |
| − | # | + | #tethaPlate のウエストウェルから、測定したテスト溶液 200 µL を取り出します。 |
| − | # | + | #次に高い濃度の希釈液 200 µL のテスト溶液と入れ替えます。 |
| − | # | + | #同じ様に少なくとも5分間、シグナルが安定するまで膜の電導度を記録します。 |
| − | # | + | #ステップ 4 ~ 6 を最大濃度のイオノフォア希釈液まで繰り返します(その前に、電導度シグナルがスケールアウトするか、膜が壊れてしまうかもしれません)。 |
| − | # | + | #tethaPlate のウエストウェルから、測定したサンプル溶液 200 µL を取り除きます。 |
| − | # | + | #200 µL の PBS 緩衝液と入れ替えます。 |
| − | # | + | #8 ~ 9 の操作を3回反復し、電導度が減少してイオノフォアが'ウォシュアウト' されたのを確認します。 |
=== '''測定結果''' === | === '''測定結果''' === | ||
| − | + | 測定した電導度をベースライン電導度(即ちイオノフォアが無い状態)で割って、電導度比を求める。 | |
| − | + | 電導度比対イオノフォア濃度の対数グラフ、または必要に応じ、濃度の対数グラフを作成します。 | |
| − | + | 急激な電導度の増加がある濃度で認められれば、良好な測定であることを示します。グラフの分解能を良くするには、テスト溶液の点数を増やし希釈濃度の幅を広めます。 | |
Latest revision as of 17:57, 3 June 2014
このプロトコールは イオノフォア や低分子 (2000 Da 以下の) イオンチャネルなどをテザードメンブレンに取り込み、tethaPod™ システムを使って膜の電導度を測定する為の手順を示したものです。測定の教材に適したイオノフォアはIonophores in Society のアプリケーションノートに記載されています。
測定前の準備として テザードメンブレン のコンセプトと tethaPod ソフトウェア の使い方を習得しておいてください。
このプロトコールで使用するバッファー溶液は PBS (リン酸緩衝食塩水) 溶液です。ただ、同様なプロトコールでも別の緩衝溶液、たとえば 0.1 M KCl、リンガー液 通常の生理食塩水、その他 Good 緩衝液、 TBS などを用いています。 ここに挙げる多くのイオノフォアは脂肪族カルボン酸基を持ち、pKa は約 4.5 ~ 5 を示します。これらは pH 6.5 以上では完全にイオン化し、水に優れた可溶性を示すのでpH 緩衝液として使用されています。二価の陽イオン (Mg2+、Ca2+ など) に対して特異性を示すイオノフォアを扱う際は、これらのイオンを一定濃度含む緩衝溶液が必要です。
Contents
膜の作成
説明書 に従ってtethaPlate をアッセンブルします。 メンブレンの作成:
- SDx-S1 リン脂質混合液, 10 µL を各インプットウェルに注入し、2分間インキュベートして脂質二重膜を形成させる。
- 各ウェルに 200 µL の PBS を加える。
- 続いて 200 µL の PBS で3回ウェルを洗う。
- ウエストウェルから余分の PBS を取り除く。
イオンチャネルの形成にエルゴステロールやコレステロールが必要な場合 (例えば Amphotericin B や Nystatin の研究など) は、膜を形成させる際に SDx-S1 リン脂質混合液に、これらの基質を加えておく必要があります。
溶液の調整
イオノフォアは通常、バイアル瓶などでミリグラムオオーダで供給されています。ストック液は供給元の容器の内容物を大きな容器に洗い出し、既知濃度に調整して保存します。通常、供給元は容器に記載したイオノフォアの量よりも多く (1 ~ 10% 程度) の量を提供します。正確に定量する必要がある場合は、使用前後の元の容器を秤量して算出します。
メタノール中に 1 mM のイオノフォアを溶かしてストック溶液とします。ストック溶液は −20°C (冷凍庫) で保存すれば長期間使用できます。一昼夜、または数日なら 2 ~ 4°C (冷蔵庫)でも保存が効きます。使用する前にストック溶液を室温に戻します。
ここで一定量のストック溶液を PBS 緩衝液で 1:100 に希釈し、10 µM (10000 nM) の希釈溶液を作成します。多くの 'lipophillic' (親油性)イオノフォアでも 10 µM 程度の濃度の水溶液なら問題なく溶かして調整できますし、それ以上濃い過飽和の状態でも構いません。 同様に、PBS緩衝液を使って 1、10、100、1000 nM の希釈溶液を作成します。
10 µM の溶液にはメタノールは僅か 1% しか含まれていません。即ち、これは水溶液と変わらない事を意味します。メタノールの濃度が高いと膜を壊したり、イオノフォアの親油性膜への配位を不完全なものにする恐れがあります。高濃度のイオノフォア溶液を使う必要がある場合は、より高濃度のストック溶液を使って (例えば 10 、ないし 100 mM、しかしこの濃度ではイオノフォアは溶けない恐れがあるので注意を要する) 、所定の濃度に希釈します。
イオノフォアを添加
測定を始める前に、使用する溶液が全て室温と平衡状態にあることを確認します。
tethaPod ユニットに取り付けて測定を始めます。各サンプルウェルのベースラインが安定するまで数分かかります。次の手順に従い:
- tethaPlate のウエストウェルから 200 µL の PB 緩衝液を吸引します。
- 直ぐに、最も低濃度のイオノフォア希釈液 200 µL と入れ替えます。
- 少なくとも5分間、シグナルが安定するまで膜の電導度を記録します。
- tethaPlate のウエストウェルから、測定したテスト溶液 200 µL を取り出します。
- 次に高い濃度の希釈液 200 µL のテスト溶液と入れ替えます。
- 同じ様に少なくとも5分間、シグナルが安定するまで膜の電導度を記録します。
- ステップ 4 ~ 6 を最大濃度のイオノフォア希釈液まで繰り返します(その前に、電導度シグナルがスケールアウトするか、膜が壊れてしまうかもしれません)。
- tethaPlate のウエストウェルから、測定したサンプル溶液 200 µL を取り除きます。
- 200 µL の PBS 緩衝液と入れ替えます。
- 8 ~ 9 の操作を3回反復し、電導度が減少してイオノフォアが'ウォシュアウト' されたのを確認します。
測定結果
測定した電導度をベースライン電導度(即ちイオノフォアが無い状態)で割って、電導度比を求める。
電導度比対イオノフォア濃度の対数グラフ、または必要に応じ、濃度の対数グラフを作成します。
急激な電導度の増加がある濃度で認められれば、良好な測定であることを示します。グラフの分解能を良くするには、テスト溶液の点数を増やし希釈濃度の幅を広めます。