Difference between revisions of "テザードメンブレン"
(→膜タンパク) |
(→tethaPod™) |
||
| (62 intermediate revisions by the same user not shown) | |||
| Line 3: | Line 3: | ||
[[File:tethaPlate6.png|400px|thumb|right|'''Figure 2.''' tethaPlate]] | [[File:tethaPlate6.png|400px|thumb|right|'''Figure 2.''' tethaPlate]] | ||
| − | テーザードメンブレンは金電極の表面に [http://en.wikipedia.org/wiki/Lipid_bilayer リン脂質二重層] をサポートする平坦膜で、一対の疎水性 [http://en.wikipedia.org/wiki/Polyethylene_glycol ポリエチレングリコール] (PEG) 鎖がアンカーと呼ばれる[http://en.wikipedia.org/wiki/Category:Organic_disulfides 有機ジスルフィド] によって金表面に共有結合しています(図 1 参照)。親油性のアルカン [http://en.wikipedia.org/wiki/Phytane フィタル基] | + | テーザードメンブレンは金電極の表面に [http://en.wikipedia.org/wiki/Lipid_bilayer リン脂質二重層] をサポートする平坦膜で、一対の疎水性 [http://en.wikipedia.org/wiki/Polyethylene_glycol ポリエチレングリコール] (PEG) 鎖がアンカーと呼ばれる[http://en.wikipedia.org/wiki/Category:Organic_disulfides 有機ジスルフィド] によって金表面に共有結合しています(図 1 参照)。親油性のアルカン [http://en.wikipedia.org/wiki/Phytane フィタル基]がPEG鎖の上部で結合し、それが骨格として働き周辺の脂質膜をクラスター化させ、強いては連鎖して膜を形成するまでになります。 |
| − | PEG鎖のジスルフィドアンカーと共に、[http://en.wikipedia.org/wiki/Phytane フィタル基] も膜を金表面に結合させるので[http://en.wikipedia.org/wiki/Tether テザー] | + | PEG鎖のジスルフィドアンカーと共に、[http://en.wikipedia.org/wiki/Phytane フィタル基] も膜を金表面に結合させるので[http://en.wikipedia.org/wiki/Tether テザー] 分子と呼ばれます。 実際には金基質上でテザー同士はスペーサと呼ばれる親油性の [http://en.wikipedia.org/wiki/Phytane フィタニル基]の無い類似の分子を介して離れています。これらのスペーサは膜の下にあって、直接膜には接していません。金基質表面はテザーとスペーサとで被覆されますが、 両者がくっつくことは無く、大きな有機ジスルフィド基のアンカーを挟んで離れています。 |
| − | + | テザーとスペースとの平均間隔は約4 nm (およそ水分子9個分) で、金表面上の膜の厚さは約40 nm (但し、0.5 nm は有機ジスルフィド基アンカが占めています)です。 | |
| − | テザーとスペースとの平均間隔は約4 nm (およそ水分子9個分)で、金表面上の膜の厚さは約40 nm (但し、0.5 | + | |
| − | + | 従って膜と金表面間のスペースはPEG鎖、ジスルフィド基アンカ群、様々なカチオンやアニオン、及び水分子の混合体で、これを総じて tethaPlasm™ と呼んでいます。これは生きた細胞の [http://en.wikipedia.org/wiki/Cytoplasm サイトプラズマ] (細胞質)に相当し、サイトプラズマのようにバルク水とは若干異なる特性を示します。 | |
| − | 一定のバイアス電圧を用いて剰余カチオンやアニオンを有するこの tehaPlasm を'チャージ' | + | 一定のバイアス電圧を用いて剰余カチオンやアニオンを有するこの tehaPlasm を'チャージ'し、tethaPatch や tehaPod の測定に活用します (下記参照)。 |
=== '''テザードメンブレンはタフです!''' === | === '''テザードメンブレンはタフです!''' === | ||
テザーとスペーサとの混合比は製造過程で異なります。標準のtethaPlate™ は膜の安定性や柔軟性が最も高いとされる1:10の割合で提供されています。 高い柔軟性が求められる場合は 1:100 程度の割合まで使えますが、これ以下では膜の品質が損なわれ推奨できません。逆に100%まで上げると、安定性が最大限得られます。 | テザーとスペーサとの混合比は製造過程で異なります。標準のtethaPlate™ は膜の安定性や柔軟性が最も高いとされる1:10の割合で提供されています。 高い柔軟性が求められる場合は 1:100 程度の割合まで使えますが、これ以下では膜の品質が損なわれ推奨できません。逆に100%まで上げると、安定性が最大限得られます。 | ||
| − | 混合比 10% | + | 混合比 10% の標準のテザードメンブレンは極めて頑丈で、調整後数ケ月のライフタイムがあります(4°C で保存すること)。膜は電気パルスに対しても極めて強く -500 ~ +800 mV の範囲の電位にも強い耐性を示しますので、従来のホールセルクランプの測定に用いられる以上の電圧をかけることが可能です。 |
== '''tethaPlate™''' == | == '''tethaPlate™''' == | ||
| − | [http://www.edaq.com/product_details_page.php?product_no=SDx-T10 tethaPlate™] は金電極 (3.0 x 0.7 mm = 2.1 mm<sup>2</sup>) | + | [http://www.edaq.com/product_details_page.php?product_no=SDx-T10 tethaPlate™] は金電極 (3.0 x 0.7 mm = 2.1 mm<sup>2</sup>) を含む6つの各チャンバーから成り、金電極表面はテザーとスペーサ分子とで被覆処理されています。適正なリン脂質ミクスチャーを加えると自発的に膜を形成します。ついで未処理の金カウンター電極を膜の上 0.15 mm にセットしますが、膜には接触させません。 |
| − | tethaPlate は極めて頑丈なハウジングなので、通常のイオンチャネル標本が数日程度しか保存できないのに比べて、シンプルなリン脂質で調整したテザード膜なら | + | tethaPlate は極めて頑丈なハウジングなので、通常のイオンチャネル標本が数日程度しか保存できないのに比べて、シンプルなリン脂質で調整したテザード膜なら 4℃で数週間は安定して保存ができます! |
tethaPlate の取り付け方とテザードメンブレンの調整法は Video 1 と 2 をご覧ください。 | tethaPlate の取り付け方とテザードメンブレンの調整法は Video 1 と 2 をご覧ください。 | ||
| Line 32: | Line 31: | ||
== '''膜タンパク'''== | == '''膜タンパク'''== | ||
| − | [[File:Ionchannels1.png|400px|thumb|right|''' | + | [[File:Ionchannels1.png|400px|thumb|right|'''図 3.''' イオンチャネルタンパク([http://en.wikipedia.org/wiki/Mechanosensitive_channels MscL. 左, と MscS]) がテザードメンブレン内にスケールされています。このタンパクの配向性に留意します。その上部が tethaPlasm の外側に収納されているのが確認できます。]] |
| − | + | 多くのタンパクは親油性部位と親水性部位から構成されており、これらがタンパクの三次構造[http://en.wikipedia.org/wiki/Protein_tertiary_structure (tertiary protein structure)] に関与しています。 親油性部位はかなりの頻度で細胞や細胞小器官、膜と結合していますので、これらのタンパクは膜タンパク[http://en.wikipedia.org/wiki/Membrane_protein (membrane proteins)] と呼ばれます。 | |
| − | + | ある種の膜タンパクは、比較的透過性のある親油性の細胞膜を通るカチオンやアニオンの輸送を促進します。このようなタンパクを [http://en.wikipedia.org/wiki/Ion_channel イオンチャネル] と呼びます。 | |
| − | |||
| − | + | テザードメンブレンのテザー/スペーサの混合比で、取り込めるタンパクの大きさが決まります。標準的な1:10の混合比では40,000 Da (言い換えれば、膜内の実際のタンパク部分)までのタンパクを取り込むのに適しているとされ、個々のタンパクはオリゴマーのポア構造に組み込まれ、最終的に一部は膜内でイオンチャンネルを形成します。 | |
| − | + | グラミジン [http://en.wikipedia.org/wiki/Gramicidin gramicidin] (1882 Da) やバリノマイシン [http://en.wikipedia.org/wiki/Valinomycin valinomycin] (1111 Da),などの最も小さいイオンチャネルのポリペプチドなどは、テザードメンブレンの中に均一に配位されます。 | |
| − | == | + | 図 3 に示すような大きなイオンチャネルでは、上部('superstructures')がメンブレン近傍の水溶液の中まで伸びています。中位のサイズのタンパクでさえ、その 'superstructures' が tethaPlasm の中に納まることは稀で、(生きた細胞で見られるように)膜タンパクは好ましい配位を取ります。 |
| − | + | ||
| − | + | == '''イオンチャネル''' == | |
| − | + | 低分子量のポリペプチドイオノフォアやイオンチャネル(グラミシジン、バリノマイシン、アラメチシン、マガイニンやイオノマイシンなど)は純正品が市販されています。デタージェントや脂質マトリックスとして販売されているタンパクもあります。大きな分子量のタンパクで供給されているものの多くは、バクテリア培養や [http://en.wikipedia.org/wiki/Genomics 遺伝子] 技術を使ったカスタムメイドで、生命工学研究室や企業から供給されています。 | |
| − | + | ||
| + | 通常バクテリア培養では該当遺伝子やRNAフラグメントを人工的にバクテリアに組み込ませ、必要なイオンチャネルタンパクを発現させます。数日培養した後、バクテリアをハーベスタ処理してタンパク化合物を分離精製(ゲル電気泳動などで)します。 | ||
| + | これらは1990年代に開発された最先端技術で、 | ||
| + | [http://en.wikipedia.org/wiki/Proteomics プロテオミクス] 研究室では盛んに活用されています。 | ||
| + | |||
| + | ヒトのゲノムでは、約400種類のイオンチャネルがコード化されていると考えられていますが、まだその一部しか詳しく研究されていません。なかでも- ナトリウム、カリウム、カルシウム、マグネシウム、塩素(などの陰イオン)- は今日的な研究対象となっています。イオンチャネルは多様性が高いので、各組織内で様々な活性モードを担っています。 例えば神経細胞内では、様々なカリウムイオンチャネルが [http://en.wikipedia.org/wiki/Action_potential アクションポテンシャル] の伝播、心拍リズム、圧変動に対する細胞の反応 ([http://en.wikipedia.org/wiki/Mechanosensitive_ion_channel (機械刺激依存性イオンチャネル)]) に関与しています。 | ||
| − | + | 類似のイオンチャネルは別の器官でも生じますが、種によっては構造を変化させ適正な機能を確保しています。 | |
| − | + | == '''イオノフォア''' == | |
| + | [[File:patchclamp1.png|400px|thumb|right|'''図 4.''' 従来のパチクランプ法 http://en.wikipedia.org/wiki/Patch_clamp]] | ||
| − | + | 天然物 (例えば[http://en.wikipedia.org/wiki/Ionomycin ionomycin] や [http://en.wikipedia.org/wiki/A23187 calicimycin])でも人工的な [http://en.wikipedia.org/wiki/Ionophore イオノフォア] (例[http://en.wikipedia.org/wiki/Crown_ether crown ethers], [http://en.wikipedia.org/wiki/Calixarene calixeranes], [http://en.wikipedia.org/wiki/Cryptand cryptands] などの [http://en.wikipedia.org/wiki/Synthetic_ion_channels 合成イオンチャネル]) 研究にもテザードメンブレンが活用できます。 イオノフォアは必ずしもポリペプチドだけではなく極めて小さな分子のものもありますが、少なくとも部分的には脂溶性で膜の内に取り込むことができます。多くのイオノフォアが抗生物質や家畜の成長促進物質、イオンセンサーとして[http://wiki.edaq.com/index.php/Ionophores_in_Society applications]で紹介されています。 | |
| − | [[ | + | |
| − | + | == '''従来のパッチクランプ法''' == | |
| − | + | 従来の [http://en.wikipedia.org/wiki/Patch_clamp パッチクランプ法] の実験では、マイクロピペット電極を使って細胞膜を捉え、単一または数個のイオンチャネルを記録します。通常は長時間試行錯誤しながら所定のポジションに電極を誘導する必要があります。標準的なイオンのカレントシグナルは極めて小さく (数ピコアンペア) 、良好なS/N比のシグナルを得るにはかなりの技能を要します。 | |
| − | + | パッチクランプから派生したホールセルクランプやオーサイトクランプ法では、多くのイオンチャネルを連続的に記録できます。この場合は大きいシグナル (かつ低ノイズ) で記録できますが、様々なタイプのイオンチャネルが存在しますので条件が複雑になるという難点もあります。 | |
| − | + | 近年、オートパッチクランプ装置が開発され発売されていますが、技術的には従来の方法を踏襲したもので、再現性のあるシグナルを得るのに難点であったマイクロピペット電極のポジショニングの問題が完全には解決されておりません。 | |
| − | + | == '''ゲノム/プロテオーム革命'''== | |
| − | + | 上述のように、21世紀初頭には [http://en.wikipedia.org/wiki/Genomics ゲノム] や [http://en.wikipedia.org/wiki/Proteomics プロテオミクス] 技術の急激な進歩によって、イオンチャンネルタンパクの分離、定量分析が可能になりました。この技術は大学をはじめ様々な研究施設、製薬企業の研究室や病院の研究部門などに急速に広まりました。 | |
| − | + | まず精製したシングルタイプイオンチャネルの定量分析のルーチン化が可能になります。研究者にとって煩雑なイオンチャネルの細孔をパッチ記録する作業からも開放されます。 | |
| − | + | [[File:tethaPatchER466.png|400px|thumb|right|'''図 5.''' tethaPatch ユニットと ER466 ポテンショスタットを使います。]] | |
| − | + | == [http://www.edaq.com/product_details_page.php?product_no=SDx-R2 '''tethaPatch'''™] == | |
| − | == | + | 人工テザードメンブレンのパッチ部位(面積0.21 ㎜2) にシングルタイプのイオンチャネルタンパクをアッセンブリすることで、1~100万個単位のチャネルを同時に測定します。この方法ではパッチ内の全イオンチャネルの総イオン電流を測定することになり、マイクロアンペア単位のシグナルを低いノイズレベルで測定できます。イオンチャネルは自発的にテザードメンブレン内に取り込まれ作用電極ともつながってますので、マイクロピペット電極を試行錯誤しながらパッチする煩雑な作業から開放されます。 |
| − | + | ||
| − | tethaPatch™ | + | tethaPatch™ 技術はホールセルパッチクランプ法と似ていますが、従来法が測定に数時間要するのに比べて分単位で測定できます。 また、テザードメンブレンは丈夫なのでかなりの電圧パルスが導入できます。従来のパッチクランプではシールが "blow"するので容易ではありませんでした。従って従来法に比べ(±300 mV程度)、電位依存性及び機械刺激依存性イオンチャネルを幅広いパルスアンプリチュード(-500~+800mV の高範囲の印加電圧が可能)で測定できます。 |
| − | + | tethaPatch の測定には [http://www.edaq.com/product_details_page.php?product_no=ER466 ER466 ポテンショスタットデータシステム] を併用します。 図 6 は発生パルスと収録するシグナルの表示です。 | |
| − | [[File:tethaPod1.png|400px|thumb|right|''' | + | [[File:tethaPod1.png|400px|thumb|right|'''図 6.''' tethaPod ユニットと背景はそのソフトウェア]] |
| − | == | + | == [http://www.edaq.com/product_details_page.php?product_no=SDx-R1 '''tethaPod'''™] == |
| − | tethaPod | + | tethaPod では、テザードメンブレンシステムを比較的大きいシグナルで扱うことができるという利点があります。tethaPlate™ の電極に振幅の小さい(20 mV) ACシグナルを周波数を変えて掛けることで、膜のコンダクタンスとキャパシタンスが直接測定できます。これは医薬品の研究開発には重要な分析テーマで、膜のコンダクタンスを連続的にモニターし、しかも [http://www.edaq.com/product_details_page.php?product_no=SDx-T10 tethaPlate™] では濃度の異なるイオンチャネルブロッカーやアクチエータを添加して分析ができます。測定結果を[http://en.wikipedia.org/wiki/Dose–response_relationship ドーズレスポンス] として解析すれば、新薬候補の迅速なスクリーニング法として活用することもできます。 |
| − | == | + | == '''参考文献''' == |
# Comparative Study of the Bacterial Sodium Channel NaChBac Function using Patch Clamp and A.C. Impedance Spectroscopy in a Tethered Membrane. Bruce A. Cornell, Gwenael Scolan, Andrew M. Powl, Sonia Carne, Bonnie A. Wallace, Biophysical Journal, 102, 3, 338a, 2012. [http://dx.doi.org/10.1016/j.bpj.2011.11.1852 DOI: 10.1016/j.bpj.2011.11.1852] | # Comparative Study of the Bacterial Sodium Channel NaChBac Function using Patch Clamp and A.C. Impedance Spectroscopy in a Tethered Membrane. Bruce A. Cornell, Gwenael Scolan, Andrew M. Powl, Sonia Carne, Bonnie A. Wallace, Biophysical Journal, 102, 3, 338a, 2012. [http://dx.doi.org/10.1016/j.bpj.2011.11.1852 DOI: 10.1016/j.bpj.2011.11.1852] | ||
# The protective effect of osmoprotectant TMAO on bacterial mechanosensitive channels of small conductance MscS/MscK under high hydrostatic pressure. Evgeny Petrov, Paul R. Rohde, Bruce Cornell, and Boris Martinac. Channels, 6:4, 1-10, 2012. [http://dx.doi.org/10.4161/chan.20833 DOI: 10.4161/chan.20833] | # The protective effect of osmoprotectant TMAO on bacterial mechanosensitive channels of small conductance MscS/MscK under high hydrostatic pressure. Evgeny Petrov, Paul R. Rohde, Bruce Cornell, and Boris Martinac. Channels, 6:4, 1-10, 2012. [http://dx.doi.org/10.4161/chan.20833 DOI: 10.4161/chan.20833] | ||
| Line 99: | Line 101: | ||
| − | + | 商標: tethaPod, tethaPatch, tethaPlate, 及び tethaPlasm は[http://www.sdxtetheredmembranes.com SDx Tethered Membranes Pty Ltd.] の商標です。 | |
Latest revision as of 18:42, 28 May 2014
Contents
テザードメンブレンとは?
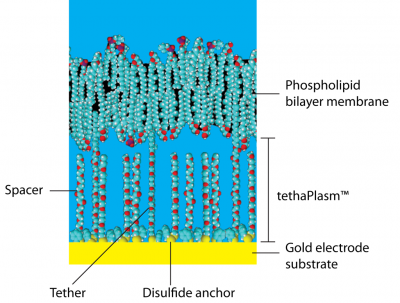
テーザードメンブレンは金電極の表面に リン脂質二重層 をサポートする平坦膜で、一対の疎水性 ポリエチレングリコール (PEG) 鎖がアンカーと呼ばれる有機ジスルフィド によって金表面に共有結合しています(図 1 参照)。親油性のアルカン フィタル基がPEG鎖の上部で結合し、それが骨格として働き周辺の脂質膜をクラスター化させ、強いては連鎖して膜を形成するまでになります。
PEG鎖のジスルフィドアンカーと共に、フィタル基 も膜を金表面に結合させるのでテザー 分子と呼ばれます。 実際には金基質上でテザー同士はスペーサと呼ばれる親油性の フィタニル基の無い類似の分子を介して離れています。これらのスペーサは膜の下にあって、直接膜には接していません。金基質表面はテザーとスペーサとで被覆されますが、 両者がくっつくことは無く、大きな有機ジスルフィド基のアンカーを挟んで離れています。
テザーとスペースとの平均間隔は約4 nm (およそ水分子9個分) で、金表面上の膜の厚さは約40 nm (但し、0.5 nm は有機ジスルフィド基アンカが占めています)です。
従って膜と金表面間のスペースはPEG鎖、ジスルフィド基アンカ群、様々なカチオンやアニオン、及び水分子の混合体で、これを総じて tethaPlasm™ と呼んでいます。これは生きた細胞の サイトプラズマ (細胞質)に相当し、サイトプラズマのようにバルク水とは若干異なる特性を示します。
一定のバイアス電圧を用いて剰余カチオンやアニオンを有するこの tehaPlasm を'チャージ'し、tethaPatch や tehaPod の測定に活用します (下記参照)。
テザードメンブレンはタフです!
テザーとスペーサとの混合比は製造過程で異なります。標準のtethaPlate™ は膜の安定性や柔軟性が最も高いとされる1:10の割合で提供されています。 高い柔軟性が求められる場合は 1:100 程度の割合まで使えますが、これ以下では膜の品質が損なわれ推奨できません。逆に100%まで上げると、安定性が最大限得られます。
混合比 10% の標準のテザードメンブレンは極めて頑丈で、調整後数ケ月のライフタイムがあります(4°C で保存すること)。膜は電気パルスに対しても極めて強く -500 ~ +800 mV の範囲の電位にも強い耐性を示しますので、従来のホールセルクランプの測定に用いられる以上の電圧をかけることが可能です。
tethaPlate™
tethaPlate™ は金電極 (3.0 x 0.7 mm = 2.1 mm2) を含む6つの各チャンバーから成り、金電極表面はテザーとスペーサ分子とで被覆処理されています。適正なリン脂質ミクスチャーを加えると自発的に膜を形成します。ついで未処理の金カウンター電極を膜の上 0.15 mm にセットしますが、膜には接触させません。
tethaPlate は極めて頑丈なハウジングなので、通常のイオンチャネル標本が数日程度しか保存できないのに比べて、シンプルなリン脂質で調整したテザード膜なら 4℃で数週間は安定して保存ができます!
tethaPlate の取り付け方とテザードメンブレンの調整法は Video 1 と 2 をご覧ください。
膜タンパク
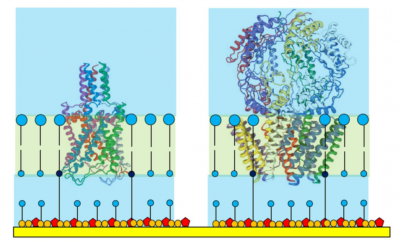
多くのタンパクは親油性部位と親水性部位から構成されており、これらがタンパクの三次構造(tertiary protein structure) に関与しています。 親油性部位はかなりの頻度で細胞や細胞小器官、膜と結合していますので、これらのタンパクは膜タンパク(membrane proteins) と呼ばれます。
ある種の膜タンパクは、比較的透過性のある親油性の細胞膜を通るカチオンやアニオンの輸送を促進します。このようなタンパクを イオンチャネル と呼びます。
テザードメンブレンのテザー/スペーサの混合比で、取り込めるタンパクの大きさが決まります。標準的な1:10の混合比では40,000 Da (言い換えれば、膜内の実際のタンパク部分)までのタンパクを取り込むのに適しているとされ、個々のタンパクはオリゴマーのポア構造に組み込まれ、最終的に一部は膜内でイオンチャンネルを形成します。
グラミジン gramicidin (1882 Da) やバリノマイシン valinomycin (1111 Da),などの最も小さいイオンチャネルのポリペプチドなどは、テザードメンブレンの中に均一に配位されます。
図 3 に示すような大きなイオンチャネルでは、上部('superstructures')がメンブレン近傍の水溶液の中まで伸びています。中位のサイズのタンパクでさえ、その 'superstructures' が tethaPlasm の中に納まることは稀で、(生きた細胞で見られるように)膜タンパクは好ましい配位を取ります。
イオンチャネル
低分子量のポリペプチドイオノフォアやイオンチャネル(グラミシジン、バリノマイシン、アラメチシン、マガイニンやイオノマイシンなど)は純正品が市販されています。デタージェントや脂質マトリックスとして販売されているタンパクもあります。大きな分子量のタンパクで供給されているものの多くは、バクテリア培養や 遺伝子 技術を使ったカスタムメイドで、生命工学研究室や企業から供給されています。
通常バクテリア培養では該当遺伝子やRNAフラグメントを人工的にバクテリアに組み込ませ、必要なイオンチャネルタンパクを発現させます。数日培養した後、バクテリアをハーベスタ処理してタンパク化合物を分離精製(ゲル電気泳動などで)します。 これらは1990年代に開発された最先端技術で、 プロテオミクス 研究室では盛んに活用されています。
ヒトのゲノムでは、約400種類のイオンチャネルがコード化されていると考えられていますが、まだその一部しか詳しく研究されていません。なかでも- ナトリウム、カリウム、カルシウム、マグネシウム、塩素(などの陰イオン)- は今日的な研究対象となっています。イオンチャネルは多様性が高いので、各組織内で様々な活性モードを担っています。 例えば神経細胞内では、様々なカリウムイオンチャネルが アクションポテンシャル の伝播、心拍リズム、圧変動に対する細胞の反応 ((機械刺激依存性イオンチャネル)) に関与しています。
類似のイオンチャネルは別の器官でも生じますが、種によっては構造を変化させ適正な機能を確保しています。
イオノフォア
天然物 (例えばionomycin や calicimycin)でも人工的な イオノフォア (例crown ethers, calixeranes, cryptands などの 合成イオンチャネル) 研究にもテザードメンブレンが活用できます。 イオノフォアは必ずしもポリペプチドだけではなく極めて小さな分子のものもありますが、少なくとも部分的には脂溶性で膜の内に取り込むことができます。多くのイオノフォアが抗生物質や家畜の成長促進物質、イオンセンサーとしてapplicationsで紹介されています。
従来のパッチクランプ法
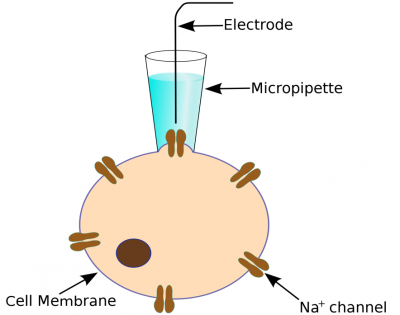
従来の パッチクランプ法 の実験では、マイクロピペット電極を使って細胞膜を捉え、単一または数個のイオンチャネルを記録します。通常は長時間試行錯誤しながら所定のポジションに電極を誘導する必要があります。標準的なイオンのカレントシグナルは極めて小さく (数ピコアンペア) 、良好なS/N比のシグナルを得るにはかなりの技能を要します。
パッチクランプから派生したホールセルクランプやオーサイトクランプ法では、多くのイオンチャネルを連続的に記録できます。この場合は大きいシグナル (かつ低ノイズ) で記録できますが、様々なタイプのイオンチャネルが存在しますので条件が複雑になるという難点もあります。
近年、オートパッチクランプ装置が開発され発売されていますが、技術的には従来の方法を踏襲したもので、再現性のあるシグナルを得るのに難点であったマイクロピペット電極のポジショニングの問題が完全には解決されておりません。
ゲノム/プロテオーム革命
上述のように、21世紀初頭には ゲノム や プロテオミクス 技術の急激な進歩によって、イオンチャンネルタンパクの分離、定量分析が可能になりました。この技術は大学をはじめ様々な研究施設、製薬企業の研究室や病院の研究部門などに急速に広まりました。
まず精製したシングルタイプイオンチャネルの定量分析のルーチン化が可能になります。研究者にとって煩雑なイオンチャネルの細孔をパッチ記録する作業からも開放されます。
tethaPatch™
人工テザードメンブレンのパッチ部位(面積0.21 ㎜2) にシングルタイプのイオンチャネルタンパクをアッセンブリすることで、1~100万個単位のチャネルを同時に測定します。この方法ではパッチ内の全イオンチャネルの総イオン電流を測定することになり、マイクロアンペア単位のシグナルを低いノイズレベルで測定できます。イオンチャネルは自発的にテザードメンブレン内に取り込まれ作用電極ともつながってますので、マイクロピペット電極を試行錯誤しながらパッチする煩雑な作業から開放されます。
tethaPatch™ 技術はホールセルパッチクランプ法と似ていますが、従来法が測定に数時間要するのに比べて分単位で測定できます。 また、テザードメンブレンは丈夫なのでかなりの電圧パルスが導入できます。従来のパッチクランプではシールが "blow"するので容易ではありませんでした。従って従来法に比べ(±300 mV程度)、電位依存性及び機械刺激依存性イオンチャネルを幅広いパルスアンプリチュード(-500~+800mV の高範囲の印加電圧が可能)で測定できます。
tethaPatch の測定には ER466 ポテンショスタットデータシステム を併用します。 図 6 は発生パルスと収録するシグナルの表示です。
tethaPod™
tethaPod では、テザードメンブレンシステムを比較的大きいシグナルで扱うことができるという利点があります。tethaPlate™ の電極に振幅の小さい(20 mV) ACシグナルを周波数を変えて掛けることで、膜のコンダクタンスとキャパシタンスが直接測定できます。これは医薬品の研究開発には重要な分析テーマで、膜のコンダクタンスを連続的にモニターし、しかも tethaPlate™ では濃度の異なるイオンチャネルブロッカーやアクチエータを添加して分析ができます。測定結果をドーズレスポンス として解析すれば、新薬候補の迅速なスクリーニング法として活用することもできます。
参考文献
- Comparative Study of the Bacterial Sodium Channel NaChBac Function using Patch Clamp and A.C. Impedance Spectroscopy in a Tethered Membrane. Bruce A. Cornell, Gwenael Scolan, Andrew M. Powl, Sonia Carne, Bonnie A. Wallace, Biophysical Journal, 102, 3, 338a, 2012. DOI: 10.1016/j.bpj.2011.11.1852
- The protective effect of osmoprotectant TMAO on bacterial mechanosensitive channels of small conductance MscS/MscK under high hydrostatic pressure. Evgeny Petrov, Paul R. Rohde, Bruce Cornell, and Boris Martinac. Channels, 6:4, 1-10, 2012. DOI: 10.4161/chan.20833
- Ion Channel Proteins that Spontaneously Insert into Lipid Bilayer Membranes: An Impedance Spectroscopy Study Employing Tethered Membranes. Bruce A. Cornell, Heba Alkhamici, Louise Brown, Sonia Carne, Sophia C. Goodchild, Russell Richards, and Stella M. Valenzuela. Biophysical Journal, 102, 682a-683a, 2012. DOI: 10.1016/j.bpj.2011.11.3710
- A High-Throughput Technique for Screening Novel Antibacterial Agents Targeting Bacterial Mechanosensitive Channels. Bruce A. Cornell, Andrew R. Battle, Sonia Carne, and Boris Martinac. Biophysical Journal, 102,122a, DOI: 10.1016/j.bpj.2011.11.683
- Making lipid membranes even tougher. Jognandan Prashar, Phillip Sharp, Mathew Scarffe, and Bruce Cornell. Journal of Materials Research, 22, 2189-2194, 2007. DOI: 10.1557/jmr.2007.0288
- Tethered Bilayer Membranes Containing Ionic Reservoirs: Selectivity and Conductance. Gowri Krishna, Jurgen Schulte, Bruce A. Cornell, Ron J. Pace, and Peter D. Osman. Langmuir, 19, 2294–2305, 2003. DOI: 10.1021/la026238d
- Tethered Bilayer Membranes Containing Ionic Reservoirs: The Interfacial Capacitance. Gowri Krishna, Jurgen Schulte, Bruce A. Cornell, Ron Pace, Lech Wieczorek, and Peter D. Osman. Langmuir, 17, 4858–4866, 2001. DOI: 10.1021/la001480a
- Tethered-bilayer lipid membranes as a support for membrane-active peptides. B. A. Cornell, G. Krishna, P. D. Osman, R. D. Pace and L. Wieczorek. Biochemical Society Transactions, 29, 613–617, 2001. DOI: 10.1042/bst0290613
- Tethered Lipid Bilayer Membranes: Formation and Ionic Reservoir Characterization. Burkhard Raguse, Vijoleta Braach-Maksvytis, Bruce A. Cornell, Lionel G. King, Peter D. J. Osman, Ron J. Pace, and Lech Wieczorek. Langmuir, 1998, 14, 648–659 1998. DOI: 10.1021/la9711239
商標: tethaPod, tethaPatch, tethaPlate, 及び tethaPlasm はSDx Tethered Membranes Pty Ltd. の商標です。